Le Comité Nobel vient tout juste d'attribuer à Emmanuelle Charpentier (France) le plus prestigieux de tous les prix. Conjointement avec Jennifer Doudna (États-Unis), une autre femme de science, elle est récompensée pour le développement de l'un des outils les plus pointus de la technologie génétique : les ciseaux génétiques CRISPR-Cas9.
Les ciseaux génétiques CRISPR-Cas9 permettent aux chercheurs de modifier l'ADN des animaux, des plantes et des micro-organismes avec une incroyable précision et en un temps record. De quoi révolutionner les sciences moléculaires de la vie, ouvrir de nouvelles voies à la sélection végétale ou encore, contribuer à des thérapies anticancéreuses innovantes et réaliser le rêve de guérir des maladies héréditaires. Et ainsi, comme le commande la tradition des prix Nobel, apporter un « grand bénéfice à l'humanité ».
Le
saviez-vous ?
Jusqu’à présent, seulement cinq femmes – sur 183 lauréats depuis 1901 – avaient été récompensées par un prix Nobel de chimie. Aujourd’hui, c’est la toute première fois que deux femmes, Emmanuelle Charpentier (France) et Jennifer Doudna (États-Unis) se voient conjointement attribuer la récompense suprême.
« J’espère que cela enverra un message positif et fort aux jeunes femmes qui envisagent une carrière scientifique », commente Emmanuelle Charpentier, jointe par téléphone au cours de la conférence de presse donnée par le Comité Nobel.
Et c'est donc pour la découverte de cet outil révolutionnaire qu'Emmanuelle Charpentier - aujourd'hui rattachée au Max-Planck Unit for the Science of Pathogens (Allemagne) - et Jennifer Doudna (université de Californie, États-Unis) viennent d'être récompensées par le prix Nobel de chimie. Ensemble, elles sont en effet parvenues à recréer les ciseaux génétiques de l'une des bactéries les plus nocives pour l'humanité dans un tube à essai et à simplifier les composants moléculaires de ces ciseaux afin qu'ils soient plus faciles à utiliser.
Dans une expérience historique, elles ont ensuite reprogrammé ces ciseaux génétiques. Dans leur forme naturelle, les ciseaux reconnaissent l'ADN des virus, mais Emmanuelle Charpentier et Jennifer Doudna ont prouvé qu'ils pouvaient être contrôlés afin de pouvoir couper n'importe quelle molécule d’ADN à un site prédéterminé.
Et l'aventure de ce prix Nobel de chimie 2020 est une fois de plus celle d'une découverte inattendue. Car c'est en étudiant le système immunitaire d'une bactérie, Streptococcus pyogenes, dans l'espoir de développer une nouvelle forme d'antibiotique qu'Emmanuelle Charpentier fait une observation étrange. Une molécule inconnue : le tracrARN. Une molécule qu'elle identifie comme un constituant d'un ancien système immunitaire des bactéries mis en place par la nature pour désarmer les virus en clivant leur ADN.
Pour mieux comprendre, il faut savoir que des chercheurs avaient déjà pu observer que le matériel génétique de bactéries très différentes - et même d'autres micro-organismes, des archées - présente des séquences d'ADN répétitives, appelées CRISPR, qui sont étonnamment bien conservées. Le même code apparaît encore et encore, mais entre les répétitions, il y a des séquences uniques qui diffèrent - et qui semblent correspondre au code génétique de différents virus. Comme une mémoire de l'infection qui aiderait à protéger les bactéries.
Mais alors, personne ne sait comment tout cela fonctionne. Les chercheurs soupçonnent qu'intervient un mécanisme nommé interférence par ARN, un phénomène dont la découverte a valu à Andrew Fire et Craig Mello, le prix Nobel de physiologie et de médecine en 2006. Et un phénomène sur lequel travaille justement Jennifer Doudna.
Elle remarque des gènes spéciaux - des gènes CRISPR associés, abrégés en Cas - très similaires aux gènes qui codent pour des protéines déjà connues et qui sont spécialisées dans le déroulement et la découpe de l'ADN. C'est ainsi que l'ADN des virus est clivé par les bactéries. Parfois selon un mécanisme complexe qui nécessite l'intervention de nombreuses protéines. Parfois selon un mécanisme plus simple.
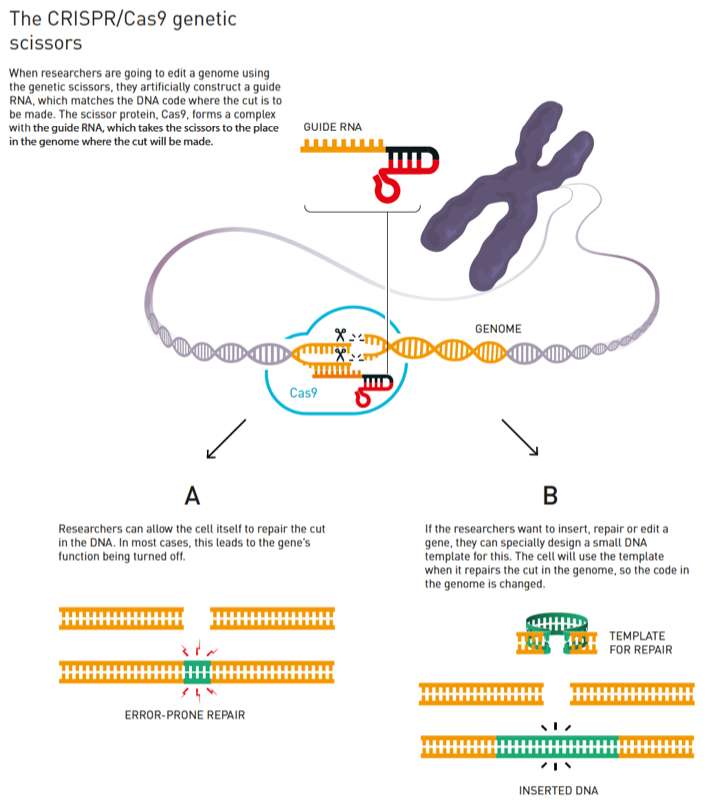
Lorsque des chercheurs veulent modifier un génome à l’aide de ciseaux génétiques, ils fabriquent au préalable un guide ARN qui correspond à l’ADN de l’endroit qu’ils souhaitent couper. Après coupure, les chercheurs peuvent laisser l’ADN se réparer tout seul (A) ou choisir d’orienter sa réparation (B). © Johan Jarnestad, Royal Swedish Academy of Sciences
 Des ciseaux génétiques à tout faire
Des ciseaux génétiques à tout faire
Emmanuelle Charpentier et Jennifer Doudna imaginent alors pouvoir déclencher le mécanisme in vitro. Grâce à de l'ARN-CRISPR, nécessaire pour identifier l'ADN d'un virus, et à Cas9, le ciseau qui coupe la molécule d'ADN. Mais il leur faudra y ajouter celle découverte par la biochimiste française : le tracrARN.
Non contentes d'avoir ainsi identifié un mécanisme fondamental chez une bactérie extrêmement nocive pour les Hommes, Emmanuelle Charpentier et Jennifer Doudna veulent aller plus loin. Simplifier leur ciseau génétique pour qu'il coupe l'ADN à l'endroit qu'elles auront déterminé. Elles parviennent à fusionner le tracrARN et le CRISPR-ARN en un ARN guide grâce auquel elles découpent un gène en cinq endroits différents.
Très vite après la publication de leurs résultats en 2012, plusieurs équipes s'emparent de l'outil. Modifier les gènes d'une cellule, d'une plante ou d'un organisme est désormais presque à la portée de tous. Et au laboratoire, les chercheurs utilisent les ciseaux génétiques développés par Emmanuelle Charpentier et Jennifer Doudna pour mieux comprendre le fonctionnement des gènes et leurs interactions.
Sur le terrain, des chercheurs sont déjà parvenus à modifier les gènes du riz de manière à ce que celui-ci absorbe moins de métaux lourds du sol. Ou à créer des cultures qui résistent mieux à la sécheresse. D'autres tentent d'exploiter les ciseaux CRISPR pour traiter la maladie de Huntington par réparation de gènes.
Mais les chercheurs doivent aussi garder à l'esprit que la puissance de cet outil pourrait être utilisée de manière moins bien intentionnée. Pour créer des embryons génétiquement modifiés, par exemple. Nous mettant face à de nouveaux problèmes éthiques à résoudre. « Mon seul objectif est de servir la science. Cette science qui nous montre les plus beaux côtés de la nature, qui nous permet de percer tous ces mécanismes que nous pouvons ensuite exploiter pour aider l'humanité », conclut Emmanuelle Charpentier, jointe par téléphone au cours de la conférence de presse donnée par le Comité Nobel.
Voir aussi EDITION DU GÉNOME ET RETOUCHE GÉNÉTIQUE PAR LE SYSTÈME CRISPER-CAS9












Aucun commentaire:
Enregistrer un commentaire